SUBSTÂNCIAS PURAS E MISTURAS
QUÍMICA
As substâncias puras são classificadas em simples e compostas, e as misturas são classificadas em homogêneas e heterogêneas.
Neste texto vamos aprender o que é e quais são as classificações das substâncias puras e misturas.
Substâncias puras
Substâncias puras são materiais que possuem composição química e propriedades físicas e químicas constantes, já que não se modificam em pressão e temperatura constantes.
De uma forma geral, as substâncias puras podem ser classificadas de duas formas:
a) Substâncias simples
São compostos químicos formados por átomos de um mesmo elemento químico. Por exemplo:
→ H2 (Gás Hidrogênio)
As moléculas do Gás Hidrogênio são formadas por dois átomos do elemento químico Hidrogênio, por isso, trata-se de uma substância simples.
→ O3 (Gás Ozônio)
As moléculas do Gás Ozônio são formadas por três átomos do elemento químico Oxigênio, por isso, trata-se de uma substância simples.
Existe ainda a possibilidade de átomos de um mesmo elemento químico formarem substâncias simples completamente diferentes, os alótropos. Um exemplo de alotropia é o caso do elemento químico Oxigênio, o qual forma as substâncias gás oxigênio (O2) e gás ozônio (O3).
São compostos químicos formados por átomos de elementos químicos diferentes. Exemplos:
→ CO2 (Gás Carbônico ou Dióxido de Carbono)
As moléculas do Gás Carbônico são formadas por um átomo do elemento carbono e dois átomos do elemento oxigênio. Como os elementos químicos são diferentes, trata-se de uma substância composta.
→ KMnO4 (permanganato de potássio)
O íon-fórmula do permanganato de potássio é formado por um átomo do elemento potássio, um átomo do elemento manganês e quatro átomos do elemento oxigênio.
Misturas
Mistura é a união de duas ou mais substâncias diferentes (independentemente se são simples ou compostas). Ela apresenta características físicas (ponto de fusão, ponto de ebulição, densidade, tenacidade etc.) diferentes e variáveis (não fixas) em comparação com as substâncias que a compõem.
A mistura de água e cloreto de sódio, por exemplo, apresenta um ponto de fusão totalmente diferente em relação aos pontos de fusão da água ( 0oC) e do cloreto de sódio (803oC) isoladamente.
a) Misturas homogêneas
O soro fisiológico é uma mistura homogênea formada por água, glicose e cloreto de sódio
As misturas homogêneas apresentam apenas uma fase (um único aspecto visual). São formadas quando um material tem a capacidade de dissolver outro. Exemplos:
- água e cloreto de sódio;
- água e glicose;
- gasolina e etanol;
- ar atmosférico (gás oxigênio, gás nitrogênio, gás carbônico, vapor de água etc);
- ácido acético e água;
- petróleo (gasolina, querosene, óleo lubrificante etc.);
- soro fisiológico.
b) Misturas heterogêneas

O leite é uma mistura heterogênea porque possui uma fase líquida (água) e uma fase sólida (gordura)
As misturas heterogêneas apresentam mais de uma fase (dois ou mais aspectos visuais). São formadas quando um material não dissolve outro. Exemplos:
- Granito;
- Leite;
- Sangue;
- Água e areia;
- Água e óleo;
- Água e gasolina.
Misturas Eutéticas e Misturas Azeotrópicas
Algumas misturas têm o comportamento igual ao de substâncias puras quando submetidas à ebulição e fusão, apesar de serem formadas por dois elementos ou compostos distintos. Elas podem se classificar em azeotrópica ou eutética:
Misturas Azeotrópicas: se comportam como se fossem substâncias puras em relação à ebulição, isto é, a temperatura mantém-se inalterada do início ao fim da ebulição (PE constante).
Exemplos: álcool etílico + água, acetona + metanol, álcool etílico + clorofórmio.
Misturas Eutéticas: se comportam como se fossem substâncias puras no processo de fusão, isto é, a temperatura mantém-se inalterada do início ao fim da fusão (PF constante).
Exemplos: ligas metálicas em geral. A solda é uma mistura eutética de Estanho e Chumbo. O bronze é uma mistura de cobre com estanho, impossível separar por fusão.
Representando graficamente:
Os gráficos a seguir representam misturas com pontos de fusão e ebulição (PF e PE) constantes indicados pelo tracejado.
Mistura azeotrópica: PF varia e PE permanece constante. O intervalo de fusão é indicado após o líquido passar pelo estado sólido.
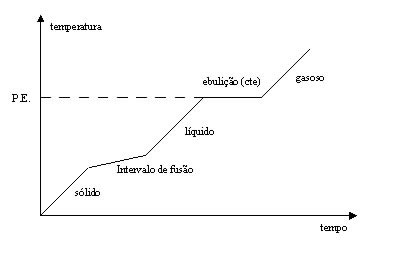
Observação: Se a curva apresentasse variação nos dois pontos (PF e PE), ela representaria uma mistura comum. Mas como apenas um dos pontos apresenta variação, no caso a temperatura de fusão, essa mistura recebe o nome de azeotrópica.
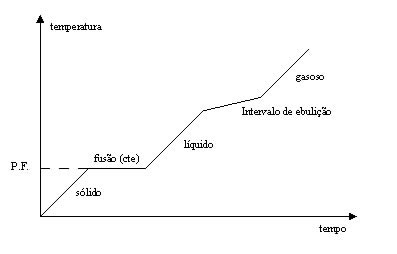
Mistura eutética: PF constante e PE variando. Repare que o intervalo de ebulição é indicado pela ascensão da reta, ou seja, a temperatura aumenta (varia), enquanto que o ponto de fusão é indicado pelo traço linear (constante).
Misturas Azeotrópicas: se comportam como se fossem substâncias puras em relação à ebulição, isto é, a temperatura mantém-se inalterada do início ao fim da ebulição (PE constante).
Exemplos: álcool etílico + água, acetona + metanol, álcool etílico + clorofórmio.
Misturas Eutéticas: se comportam como se fossem substâncias puras no processo de fusão, isto é, a temperatura mantém-se inalterada do início ao fim da fusão (PF constante).
Exemplos: ligas metálicas em geral. A solda é uma mistura eutética de Estanho e Chumbo. O bronze é uma mistura de cobre com estanho, impossível separar por fusão.
Representando graficamente:
Os gráficos a seguir representam misturas com pontos de fusão e ebulição (PF e PE) constantes indicados pelo tracejado.
Mistura azeotrópica: PF varia e PE permanece constante. O intervalo de fusão é indicado após o líquido passar pelo estado sólido.

Observação: Se a curva apresentasse variação nos dois pontos (PF e PE), ela representaria uma mistura comum. Mas como apenas um dos pontos apresenta variação, no caso a temperatura de fusão, essa mistura recebe o nome de azeotrópica.

Mistura eutética: PF constante e PE variando. Repare que o intervalo de ebulição é indicado pela ascensão da reta, ou seja, a temperatura aumenta (varia), enquanto que o ponto de fusão é indicado pelo traço linear (constante).
Nenhum comentário:
Postar um comentário